تُعد الجودة والدقة والكفاءة من الأمور الحيوية لضمان نجاح أي علاج لتأخر الانجاب. إن تقنيات تحضير الحيوانات المنوية التقليدية، مثل الطرد المركزي باستخدام تدرج الكثافة، ليست فقط شاقة وصعبة، ولكنها تساهم بالإضافة إلى ذلك في تكسر الحمض النووي للحيوانات المنوية والإجهاد الخلوي، مما يقلل من فرص نجاح العلاج.
تُعد أجهزة الزايموت لفصل الحيوانات المنوية طريقة مبتكرة وفعالة وطبيعية وبسيطة لعزل الحيوانات المنوية الأكثر صحة وسلامة من أجل عمليات الحقن المجهري وأطفال الانابيب وحتى التلقيح الصناعي وذلك بأقل قدر من التكسر في الحيوانات المنوية.
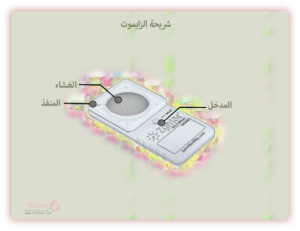
ما هو الزايموت ؟
الزايموت هو جهاز فاصل للحيوانات المنوية، وغالباً ما يُعرف باسم الشريحة، يُستخدم في مختبرات التلقيح الصناعي لتحضير واختيار الحيوانات المنوية للحقن المجهري وأطفال الانابيب والتلقيح الصناعي. يستخدم جهاز الزايموت مرشح غشائي داخل الشريحة يسمح فقط للحيوانات المنوية الأكثر حركة وسلامة بالمرور من خلالها.
تم تصميم هذه التقنية لمحاكاة الحمل الطبيعي عن طريق اختيار الحيوانات المنوية بناءً على مدى قدرتها على السباحة بنشاط مع تجنب الطرد المركزي، والذي يمكن أن يجهد الحيوانات المنوية وقد يسبب في تلف أغشيتها.
تاريخ الزايموت وتطوره
يُعد الزايموت تطوراً مهماً في مجال علاجات تأخر الانجاب. وقد تم تطوير الجهاز استجابة للحاجة إلى طرق أفضل لاختيار الحيوانات المنوية التي يمكن أن تعالج المشاكل المرتبطة بتقنيات معالجة الحيوانات المنوية التقليدية، مثل الطرد المركزي، والتي يمكن أن تسبب تلف أغشية الحيوانات المنوية. يستخدم جهاز الزايموت غشاءً دقيقاً متخصصاً يسمح فقط بمرور الحيوانات المنوية الأكثر صحة والأكثر حركة، وبالتالي تحسين جودة الحيوانات المنوية المختارة لعمليات الإخصاب.

كيف يعمل الزايموت ؟
يعمل جهاز الزايموت على مفهوم الموائع الدقيقة، حيث يتم وضع الحيوانات المنوية في مدخل الجهاز ويُسمح لها بالمرور عبر مرشح. تتضمن العملية ما يلي:
- يقوم علماء الأجنة بحقن السائل المنوي في منفذ مدخل جهاز الزايموت .
- تسبح الحيوانات المنوية الأكثر حركة وصحية عبر مرشح الغشاء الداخلي قبل أن يتم جمعها واستخدامها للعلاج. تُترك الحيوانات المنوية الأقل جودة لأنها غير قادرة على المرور عبر حاجز الغشاء.
- ثم يتم جمع الحيوانات المنوية المختارة عالية الجودة لاستخدامها في عمليات أطفال الانابيب أو الحقن المجهري.
على عكس الطرق التقليدية، لا تتطلب معالجة عينة من السائل المنوي باستخدام جهاز الزايموت أي طرد مركزي، والذي يُعتقد أنه أحد الأسباب الرئيسية لتكسر الحمض النووي في عينات الحيوانات المنوية الضعيفة.

ما الفرق بين البيكزي والزايموت ؟
كل من البيكزي والزايموت هما جهازا اختيار الحيوانات المنوية في دورات الحقن المجهري وأطفال الانابيب. البيكزي هو عبارة عن طبق يحتوي على نقاط هيالورونان دقيقة حيث ترتبط الحيوانات المنوية الناضجة بالهيالورونان حتى يمكن اختيارها واستخدامها في الحقن المجهري. أما الزايموت عبارة عن جهاز ميكروفلويدي دقيق يقوم بفرز الحيوانات المنوية المتحركة والطبيعية شكلياً ويقلل من الحيوانات المصابة بتكسر الحمض النووي.
على الرغم من وجود دراسات تدعم الاستخدام السريري لكلا الجهازين في دورات الحقن المجهري وأطفال الانابيب، إلا أن الأدبيات الحالية مثيرة للجدل فيما إذا كانت هذه الأجهزة تحسن من نتائج الحمل بينما تزيد من تكلفة الدورة. وفقًا لإحدى الدراسات، قلل استخدام الزايموت من تكسر الحمض النووي للحيوانات المنوية وزاد من معدلات الانغراس والحمل السريري. وعلى النقيض من ذلك، أظهرت مولي وآخرون عدم وجود فروق في معدلات الحمل السريري أو الحمل المستمر بين طريقة الزايموت مقابل طريقة اختيار الحيوانات المنوية الروتينية.
فوائد استخدام الزايموت في الحقن المجهري
فيما يلي بعض فوائد استخدام الزايموت :
- يقوم الزايموت بعزل الحيوانات المنوية الأكثر حركة وصحة بشكل فعال، مما يؤدي إلى أجنة ذات جودة أعلى ومعدلات حمل أعلى.
- لا يستخدم الزايموت الطرد المركزي، كما أن العملية لطيفة وتشبه عملية الانتقاء الطبيعي في الجهاز التناسلي الأنثوي.
- وقد وجدت الدراسات البحثية أن شريحة الزايموت يمكن أن تزيد من معدلات الحمل السريري، خاصةً لدى الأفراد الذين يعانون من تأخر الانجاب عند الرجال.
- وتتطلب أجهزة الزايموت وقتاً تقنياً أقل بنسبة 80% تقريباً، مما يؤدي إلى تقليل احتمالية حدوث خطأ بشري.
من يجب أن يفكر في استخدام الزايموت ؟
تُعد تقنية الزايموت خيارًا جيدًا للعديد من الأفراد الذين يحتاجون إلى علاج الخصوبة من أجل الإنجاب. قد يكون هذا النهج فعالاً بشكل خاص للذكور الذين يعانون من انخفاض جودة الحيوانات المنوية ولديهم ارتفاع كبير في نسبة تكسر الحمض النووي في الحيوانات المنوية، وكذلك الأزواج الذين تعرضوا للفشل المتكرر في دورات الحقن المجهري. الا ان المختبر يحتاج الى ما لا يقل عن مليون حيوان منوي متحرك بشكل تدريجي لكل مل حتى يتمكن من استخدام الزايموت للحقن المجهري، وبالتالي فإن العينات التي تحتوي على أعداد أقل من الحيوانات المنوية المتحركة أو ذات الحركة الضعيفة جداً ستحتاج إلى تحضيرها باستخدام الطريقة التقليدية.
هل تقنية الزيموت فعالة؟
يعتبر الزايموت تقنية جديدًا نسبيًا، لذلك لا يتوفر قدر كبير من الأدلة التي تدعم استخدامه وتؤكد فوائده التي تم الإبلاغ عنها من قبل العديد من الفرق البحثية والسريرية. وخلصت الأدبيات العلمية الحديثة عن الزايموت إلى ما يلي:
- أسفرت تقنية الزايموت عن أعداد أقل بكثير من الحيوانات المنوية من طرق التحضير المعتادة.
- كان أداء الحيوانات المنوية التي تم تحضيرها باستخدام الزايموت أفضل بكثير من الإجراءات التقليدية من حيث الحركة الكلية ومورفولوجيا (شكل وتشوهات) الحيوانات المنوية المناسبة نسبة تكسر الحمض النووي للحيوانات المنوية.
- لم يكن هناك اختلاف في الطرق المستخدمة للحركة التدريجية.
- جمعت الزايموت الحيوانات المنوية الأكثر صحة مع نسبة تكسر الحمض النووي أقل عند مقارنتها بإجراءات تحضير الحيوانات المنوية المستخدمة بانتظام.
- وأخيراً، أدى فصل الحيوانات المنوية باستخدام الزايموت للحقن المجهري إلى زيادة احتمالية حدوث حمل سريري مقارنةً بطرق تحضير الحيوانات المنوية التقليدية.
التطبيقات السريرية ل الزايموت
عادةً ما يتم إجراء الزايموت جنباً إلى جنب مع الحقن المجهري، والذي يتضمن حقن حيوان منوي واحد مباشرة في البويضة. هذا النهج مفيد بشكل خاص للأفراد الذين يعانون من انخفاض أعداد الحيوانات المنوية أو ضعف حركة الحيوانات المنوية. يمكن استخدام هذه التقنية أيضاً في عمليات التلقيح الصناعي مما يزيد من أهميتها السريرية في علاجات تأخر الانجاب.
المصادر
Selection of functional human sperm with higher DNA integrity and fewer reactive oxygen species
Passively driven integrated microfluidic system for separation of motile sperm
Comparison of chromatin assays for DNA fragmentation evaluation in human sperm





